فیزیولوژی درد ؛ گیرنده ها و مسیر های صعودی و نزولی درد | کافه پزشکی
درد نشانه عمومی اکثر بیماری ها بوده بطوریکه شایع ترین علت مراجعه به پزشکان محسوب می گردد. درد به صورت: “یک تجربه حسی و عاطفی ناخوشایند است که با آسیب احتمالی یا واقعی بافت در ارتباط بوده و یا در روند این گونه آسیب ها به وجود می آید” تعریف می شود. درد حاد (Acute pain) به دنبال وقوع ناگهانی آسیب (جراحی یا ضربه)، بیماری های حاد و التهابی بروز کرده و عامل حدود ۳۳ درصد مراجعات به پزشکان می باشد ولی درد مزمن (Chronic pain)، دردی است دائمی یا متناوب که به مدت حداقل سه ماه استمرار پیدا می کند. شیوع درد مزمن با افزایش سن افزایش یافته بطوری که در سن بالای ۵۵ سالگی شیوع آن حداقل ۲۰% می باشد. همراه کافه پزشکی باشید
درد حاد باعث اضطراب ولی درد مزمن باعث افسردگی در بیمار می شود. مردان درد حاد و زنان درد مزمن را بهتر تحمل می کنند. به کمترین حد درد که یک شخص قادر به تشخیص آن می باشد آستانه درد گفته می شود و به بیشترین میزان درد که یک فرد آمادگی تحمل آن را دارد سطح تحمل درد گفته می شود. آسان ترین روش محاسبه آستانه درد، گرما و اندازه آن معمولا ۴۴ درجه سانتیگراد می باشد. آستانه درد از یک فرد طبیعی به فرد دیگر ثابت ولی سطح تحمل درد در افراد مختلف متغیر می باشد.
آنچه در این پست کافه پزشکی خواهید دید
گیرنده های درد و مکانیسم ایجاد درد
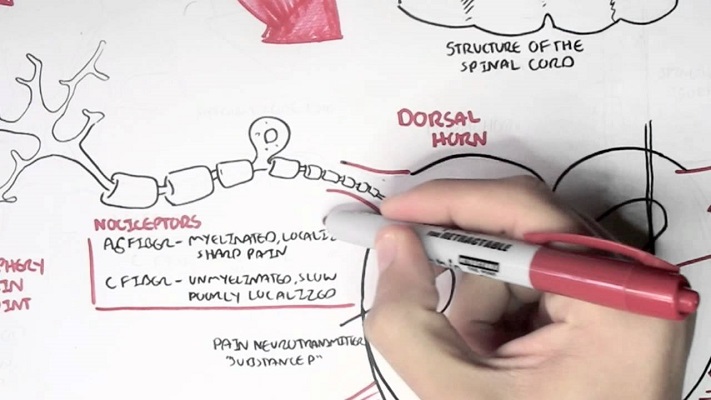
گیرنده های عصبی در سرتاسر بدن متنوع و تخصص یافته بوده، بطوری که از نظر شکل، عملکرد و نوع محرک با یکدیگر فرق دارند. به عنوان مثال گیرنده های نوری چشم به نور، گیرنده های شنوایی گوش داخلی به ارتعاشات صوتی، گیرنده های نو در بینی به بو و گیرنده های چشائی زبان به انواع مزه ها به طور اختصاصی حساس می باشند. گیرنده های درد تخصیص یافته ماکروسکوپیک نبوده بلکه به صورت پایانه های آزاد عصبی (Free nerve Ending) و به نام نامی سپتور (Noticeptor) می باشد.
ناسی سپتورها به دو گروه کلی زیر تقسیم می شوند:
- سوماتیک (Somatic n)
- احشائی (Visceral n)
ناسی سپتورهای سوماتیک دو دسته اند:
۱- گیرنده های سطحی (super ficial noticeptors) : که در سطح پوست پراکنده شده اند.
۲- گیرنده های عمقی (Deep noticeptors): که در عضلات، فاشیا ها، مفاصل و بافت های همبند دیده می شوند. به عنوان مثال آسیب تروماتیک عضلات یا تحریکات شیمیایی ناشی از تجمع الاکتات و پتاسیم در ورزشکاران باعث گرفتگی و درد شدید عضلانی می شود. با انواع دردهای روماتیسمی توسط این گروه گیرنده ها به مغز منتقل می گردند.
ناسی سپتورها در پوست، بافت های عمقی و احشاء پراکنده بوده و میزان پراکندگی آنها در جاهای مختلف بدن متفاوت می باشد، به عنوان مثال تعداد این گیرنده ها در نوک انگشتان کمتر و در قرنیه چشم بیشتر است.
گیرنده های احشائی در احشاء داخلی بدن انتشار یافته و مکانیسم تحریک آنها متنوع می باشد. در احشاء تو خالی مثل کولون و معده، گیرنده های درد در اثر اتساع تحریک می شوند ولی در احشاء توپر تحریک گیرنده های درد با فشار دادن حاصل می گردد. ناسی سپتورها عموما فقط به تحریکاتی که در بافت ایجاد آسیب یا تهدید به آسیب نمایند پاسخ می دهند. لذا محرک هایی که نتوانند آسیب بافتی ایجاد کنند تحریک ناسی سپتور نمی دهند. سرعت هدایت ایمپالس در ناسی سپتورها کندتر و ۳۰-۰/۵ متر در ثانیه ولی در سایر رسپتورها سریعتر و ۱۲۰-۳۰ متر در ثانیه می باشد.
محرک های ناسی سپتورها به سه دسته تقیسم می شوند:
۱- محرک های شیمیایی: با آسیب سلولی مواد شیمیایی داخل سلول ها به بیرون از سلول ها وارد و باعث تحریک گیرنده های درد می شود. این مواد شامل پروستاگلاندین ها (از جمله PGE1 ،PGE2 و PGD2)، هیستامین، برادی کینین، سروتونین، لوکوترین ها، ترومبوکسان و ماده P می باشد.
داروهایی که در ارتباط با عملکرد مواد شیمیایی فوق می باشند می توانند در مهار درد مؤثر باشند، به عنوان مثال داروهای ضد التهابی غیر استروئیدی و آسپیرین با مهار آنزیم سیکلو اکسیژناز مانع تولید پروستاگلاندین ها شده لذا در کنترل درد ناشی از آسیب های بافتی مؤثر خواهند بود مواد اسیدی و یا قلیایی در بافت ها باعث ایجاد درد می گردد. به عنوان مثال تزریق لیدوکائین جهت بی حسی موضعی همزمان با تزریق آن باعث درد می شود. تیوپنتال سدیم (nesdonal) با داشتن PH قلیایی در صورت تزریق زیر جلدی درد شدیدی ایجاد می نماید. یکی از مکانیسم های ایجاد درد در آبسه های بافتی مواد اسیدی تولید شده توسط آبسه می باشد.
۲- محرک های حرارتی می توانند با تحریک گیرنده های درد باعث ایجاد درد گردند.
۳- محرک های مکانیکی (فشار و ضربه) نیز از عوامل تحریک ناسی سپتورها می باشند.
الیاف عصبی آوران درد
پیام های عصبی حاصله از تحریک ناسی سپتورها توسط الیاف عصبی اختصاصا نوع Aδ و C به سمت نخاع انتقال می یابند. الیاف عصبی دخیل در انتقال ایمپاس های درد یا تسکین درد شامل :
- الیاف Large fibers) A)
- الیاف Small fibers) C)
الیاف A انواع مختلف داشته که فقط دو نوع آن به شرح زیر در انتقال ایمپاس های درد و یا تسکین درد نقش دارند:
الف) الیاف ABeta ) Aβ ) : این الیاف دارای میلین ضخیم بوده و درشت ترین و طولانی ترین فیبرهای عصبی محسوب می گردند و به علت داشتن گره های رانویه و میلین سریع ترین انتقال پیام های عصبی را دارا می باشند.
این الیاف ناقل حس لمس، ارتعاش و فشار بوده و در مکانیسم اثر روش تسکینی TENS (تحریک الکتریکی عصب از طریق پوست) به طریقی که بعدا در مبحث gate control) اشاره خواهد شد دخیل می باشد. لذا این الیاف در انتقال ایمپالس های درد نقشی نداشته ولی در تسکین درد دخالت دارند. سرعت انتقال ایمپالس عصبی در این الیاف ۷۰-۳۰ متر در ثانیه می باشد.
ب) الیاف A Delta ) Aδ ): این الیاف نیز میلین دار بوده ولی میلین اینها کمتر از میلین Aβ می باشد. همچنین این الیاف نسبت به الیاف Aβ کوچکتر، کوتاه تر و سرعت انتقال کمتری (۳۰-۱۲ متر در ثانیه) دارند. این الیاف ناقل پیام های درد و حرارت بوده و در بر گیرنده ۲۵ درصد ناسی سپتورها می باشند. تحریک الیاف Aδ باعث ایجاد درد موضعی (Localized)، تیز (sharp)، سوزنی (prickly) ناگهانی شده و در طب سوزنی کاربرد دارند.
الیاف C : این الیاف نازک ترین و کوتاه ترین فیبرهای عصبی بوده و به دلیل نداشتن میلین و در نتیجه فقدان گره های رانویه دارای کمترین سرعت انتقال پیام عصبی یعنی ۲-۰/۵ متر در ثانیه می باشند. این الیاف در بر گیرنده ۷۵٪ ناسی سپتورها بوده و مانند الیاف Aδ ناقل پیام های درد می باشند. تحریک الیاف C باعث احساس درد غیر موضعی و در سطح وسیع (poorly localized)، مداوم و پایدار، مبهم و کند (dull) و سوزشی (Burning) می گردد.
نقش نخاع در انتقال و تعدیل ایمپالس های درد
الیاف Aδ و C از طریق ریشه پشتی (Dorsal Root) وارد شاخ خلفی ماده خاکستری نخاع شده در آنجا خاتمه یافته و پس از سیناپس با نورون بعدی به سمت مقابل طی مسیر می کند. سیناپس محل اثر داروها و نوروترانس میترها (واسطه های عصبی می باشد. مخدرها با آزاد کردن ترانس میترهای مهاری در سیناپس باعث مهار انتقال بیشتر پیام عصبی به مراکز بالاتری می شود.
سیناپس در حقیقت محل تعدیل (Modulation) پیام های عصبی است. در سال ۱۹۶۵ تئوری کنترل دریچه ای (Gate – control theory) توسط دو دانشمند به نام های ملزاک (Melzack) و وال (Wall) بدین صورت توضیح داده شد در شاخ خلفی نخاع منطقه ای به نام Substantia gelatinosa وجود دارد و سیستم Gate Control با عاملیت سلول Transmission cell) T) در آن قرار گرفته است.
با تحریک الیاف C و Aδ پیام های درد وارد Substantia gelatinosa در نخاع شده و با اعمال اثر تحریکی روی دریچه باعث باز شدن آن و انتقال پیام عصبی به مراکز بالاتر شده و به مغز می رسد. هر چه شدت تحریکات دردناک زیاد باشد دریچه بیشتر باز می شود. به عبارت دیگر با تحریک الیاف C انتقال درد به مراکز بالاتر تسهیل می یابد. بر عکس عواملی وجود دارند که با اعمال اثر مهاری روی دریچه باعث بسته شدن آن می گردند
الف – عواملی که از بیرون، دریچه را به سمت خود می کشد:
تحریک الیاف Aβ با ارتعاش، لمس و الکتریسیته باعث اعمال اثر مهاری روی دریچه به واسطه ترشح انکفالین ها (از مخدرهای درونزا) در شاخ خلفی و در نتیجه بسته شدن آن می گردد. از نظر بالینی ماساژ دادن محل درد، فیزیوتراپی محل درد با ارتعاش (vibration)، تحریک الکتریکی محل درد (روش TENS) و نیز طب سوزنی با تحریک الیاف Aβ باعث بسته شدن دریچه گردیده و در نتیجه انتقال پیام درد به مراکز بالاتر کاهش یافته و منجر به تسکین درد می شود. تزریق مخدر در مایع مغزی نخاعی (CSF) با نفوذ به محل سیناپس های عصبی در شاخ خلفی باعث بسته شدن دریچه و تسکین درد می گردد. در هرپس زوستر (زونا) الیاف Aβ از بین رفته لذا تسکین درد ناشی از آن با طب سوزنی بهبود نمی یابد.
ب- عواملی که از داخل دریچه را به سمت بیرون هدایت می کند:
پیام های درد ارسالی از محیط وارد نخاع و سپس مغز شده، مغز در پاسخ به آن به سمت نخاع پیام های مهاری ارسال می دارد. پیام های مهاری به واسطه مواد شیمیایی و نوروترانسمیتر های آدرنرژیک، گاما آمینو بوتیریک اسید (GABA)، سروتونین (۵HT) و بتا اندورفین ها عمل نموده و سیستم های مهاری نزولی روی دریچه اثر مهاری داشته و باعث بسته شدن دریچه می گردد.
لذا ورود ایمپالس های درد از محیط به سمت مغز کاهش یافته و در نتیجه احساس درد در بیمار کاهش می یابد. در داخل و اطراف غده هیپوفیز مخدر درونزائی به نام بتا اندروفین ها وجود دارد که با تحریک الکتریکی آن محل آزاد شده و باعث بسته شدن دریچه و تسکین درد می گردد.
مسیرهای صعودی درد
الیاف Aδ و C پس از ورود به شاخ پشتی نخاع در آنجا سیناپس کرده به سمت مقابل ادامه مسیر می دهد. الیاف Aδ از طریق مسیر نخاعی – تالاموسى ( spino– thalamic ) به سمت تالاموس صعود نموده و درد در تالاموس احساس می گردد. در ادامه، پس از سیناپس به سمت قشر حسی مغز حرکت نموده درد در آنجا درک می گردد در حقیقت شدت و منشأ درد را تشخیص می دهد. میزان درک درد به شدت تحریک، اضطراب، میزان آسیب بافتی، گیجی و حواس پرتی بستگی دارد. الیاف C از طریق مسیر نخاعی – شبکه ای ( spino – reticular ) به سمت ساختمان مشبک (Reticular formation) صعود کرده پس از سیناپس در آنجا به سمت تالاموس ادامه مسیر می دهد. این الیاف نیز مانند Aδ در تالاموس پس از سیناپس مجدد به سمت قشر حسی مغز ادامه مسیر می دهد.
مسیر نزولی درد
مسیر الیاف آوران درد به قشر حسی مغز منتهی شده و مغز در مقابل دریافت پیام های درد از خود واکنش نشان داده و از طریق سیستم های مهاری نزولی باعث بسته شدن دریچه و در نتیجه کاهش درد و واکنش های محیطی (الف – تحریک سمپاتیک: افزایش ضربان قلب و فشار خون، گشاد شدن مردمک های سفتی عضلات اسکلتی، تاکی پنه، تعریق و رنگ پریدگی. ب – تحریک پاراسمپاتیک: تهوع، استفراغ، ضعف، بی حالی، کاهش هوشیاری، کاهش ضربان قلب، کاهش فشار خون، رنگ پریدگی ج – واکنش های رفتاری) می گردد.
ماده خاکستری دور قنات سیلویوس (PAG) حاوی انکفالین ها و بتا اندورفین بوده و با تحریک الکتریکی آن درد تسکین می یابد. تحریک هسته سجافى (Raphe Magnus) که در ساقه مغز قرار دارد می تواند منجر به مهار ایمپالس های درد در محل دریچه گردد. تزریق مرفین به داخل PAG درد را با فعال کردن یک مسیر نزولی که موجب مهار انتقال آوران های اولیه در شاخ پشتی نخاع می شود، تسکین می دهد.
این فعال شدن از طریق نورون های رابط PAG و هسته سجافی به انجام می رسد و آنگاه الیاف سروتونینرژیک نزولی از هسته رافه به شاخ پشتی نخاع وارد و درد را با بستن دریچه مهار می کند.
منبع : دکتر سید محسن پوریعقوبی ، آنستزیولوژیست
اختصاصی کافه پزشکی